Wärme bezeichnet in der Thermodynamik ein Energietransport aufgrund einer Temperaturdifferenz. Wärmeenergie ist in diesem Sinne niemals „Inhalt“ eines Gegenstandes!
Temperaturangleichung zweier Stoffe
Die Alltagserfahrung zeigt, dass sich die Temperaturen zweier Gegenstände mit der Zeit angleichen, wenn man diese in Kontakt miteinander bringt. Irgendwann hat sich schließlich eine gemeinsame Gleichgewichtstemperatur eingestellt. Dies zeigt sich zum Beispiel beim Eingießen von relativ kühler Milch in eine Tasse heißen Kaffees. Nach einer kurzen Zeit stellt sich eine gemeinsame Mischtemperatur zwischen Milch und Kaffee ein. Diese Mischtemperatur befindet sich irgendwo zwischen beiden Ausgangstemperaturen.
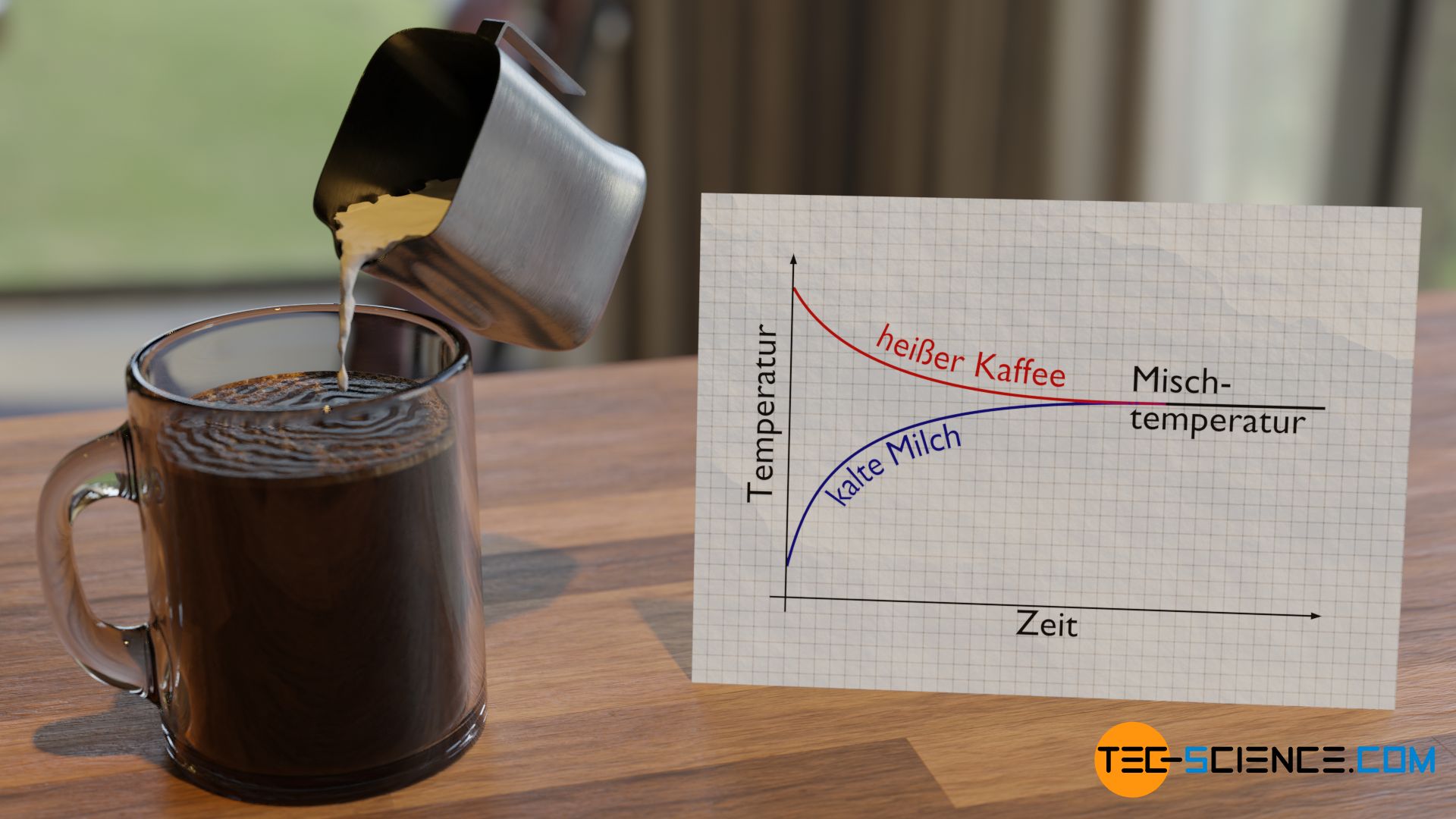
Mithilfe des Teilchenmodells lässt sich dieser Vorgang der Temperaturangleichung anschaulich nachvollziehen. Zunächst haben die Teilchen im Kaffee aufgrund der höheren Temperatur eine größere Bewegungsenergie als jene Teilchen in der Milch. Salopp formuliert, sind die Teilchen im Kaffee also schneller als die Teilchen in der Milch. Wird die Milch nun in den Kaffee gegossen so stoßen die unterschiedlichen Teilchen durch deren thermische Bewegung ständig aneinander. Dabei werden die „kühlen“ und damit langsamen Milchteilchen von jenen „heißen“ und somit schnellen Kaffeeteilchen angestoßen.

Die relativ langsamen Milchteilchen werden hierdurch schneller. Dies geht folglich mit einer Erhöhung der Temperatur einhergeht. Umgekehrt werden die schnellen Kaffeeteilchen von jenen langsamen Milchteilchen beim Zusammenstoß abgebremst. Die schnellen Kaffeeteilchen werden hierdurch langsamer, was folglich mit einer Erniedrigung der Temperatur einhergeht. Durch diesen Energieaustausch zwischen den Milchteilchen und den Kaffeeteilchen kommt es schließlich mit der Zeit zu einer gegenseitigen Annäherung der Bewegungsenergien und damit zu einer gemeinsamen Gleichgewichtstemperatur (siehe hierzu auch Artikel Gleichverteilungssatz).
Die schnelleren Kaffeeteilchen haben also ihrerseits eine „beschleunigende“ Wirkung auf die langsameren Milchteilchen. Umgekehrt haben die langsameren Milchteilchen eine „abbremsende“ Wirkung auf die schnelleren Kaffeeteilchen. Wenn nun relativ viel kalte Milch eingegossen wird, so ist makroskopisch betrachtet die „abbremsende“ Wirkung relativ stark ausgeprägt. Die Gleichgewichtstemperatur wird sich in diesem Fall in Richtung kühleren Temperaturen hin verschieben. Wird hingegen nur wenig kalte Milch dazu gegeben, so wird die „abbremsende“ Wirkung geringer sein und die Gleichgewichtstemperatur entsprechend höher.
Modellvorstellung
Man kann das Angleichen der Bewegungsenergie in einem Modell anschaulich nachvollziehen. Hierzu betrachtet man zwei Kammern, die zunächst durch eine Trennwand voneinander separiert sind. In der linken Kammer befinden sich Kugeln, die sich relativ schnell bewegen. In der rechten Kammer hingegen bewegen sich die Teilchen relativ langsam. Die Kugeln in der linken Kammer stehen somit für einen Stoff mit hoher Temperatur und die Kugeln in der rechten Kammer für einen Stoff mit geringer Temperatur.

Öffnet man nun die Trennwand, dann prallen die unterschiedlich schnellen Kugeln permanent zusammen. Hierdurch übertragen die schnelleren Kugeln einen Teil ihrer Bewegungsenergie auf die langsameren Teilchen. Nach hinreichend langer Zeit, haben sich die Energie angeglichen und eine gemeinsame Gleichgewichtstemperatur hat sich eingestellt.
Thermodynamisches Gleichgewicht
Sowohl im beschriebenen Modell als auch in der Realität finden auch nach dem Angleichen der Temperaturen immer noch Stoßprozesse zwischen den Teilchen statt. Diese Stöße führen aber makroskopisch betrachtet nicht mehr zu einem (Netto-)Austausch von Energie. Denn während zwar an einer Stelle vielleicht ein Teilchen wieder schneller wird, verlangsamt sich dafür an anderer Stelle wieder eines. Makroskopisch betrachtet, bleibt der thermische Gleichgewichtszustand also erhalten. Man spricht in diesem Zusammenhang auch von einem sogenannten dynamischen Gleichgewicht bzw. in diesem Fall vom thermodynamischen Gleichgewicht.
Als thermodynamisches Gleichgewicht bezeichnet man einen Zustand, in dem auf makroskopisch messbarer Ebene kein Austausch von Energie mehr stattfindet, d.h. insbesondere sich eine gemeinsame Gleichgewichtstemperatur eingestellt hat!
Der Wärmebegriff
Offensichtlich wird während der stattfindenden Stoßprozesse Energie von den relativ schnellen Teilchen des heißen Stoffes auf die relativ langsamen Teilchen des kälteren Stoffes übertragen. Dieser Energieaustausch zwischen den Teilchen zweier Stoffe, die mit unterschiedlichen Temperaturen in Kontakt miteinander gebracht werden, bezeichnet man in der Thermodynamik als Wärme oder Wärmeenergie.

Wärme bezieht sich im thermodynamischen Sinne also nur auf den eigentlichen Prozess des Energietransports von einem heißen Gegenstand auf einen kühleren Gegenstand. Deshalb zählt die Wärmeenergie auch zu den sogenannten Prozessgrößen (siehe hierzu auch Artikel Die Prozessgrößen: Wärme und Arbeit).
Der Begriff Wärme beschreibt demnach eben nicht den energetischen Zustand eines Stoffes, d.h. nicht die Eigenschaft „heiß“ oder „kalt“ zu sein. Einen solchen energetischen Zustand eines Stoffes auf „innerer“ atomarer Ebene beschreibt die innere Energie als sogenannte Zustandsgröße.
Wärme bezeichnet im thermodynamischen Sinne den Energieübertrag von einem heißeren Stoff auf einen kälteren Stoff (Anstreben des thermodynamischen Gleichgewichts)!
Wärmeenergie wird in der Thermodynamik meist mit dem Symbol Q gekennzeichnet. Da sie eine Energiegröße ist, besitzt sie die Einheit J („Joule“).
Illustratives Beispiel zur Wärmeenergie
Die Begriffe Temperatur, Wärme und innere Energie werden vor allem im Alltag nicht korrekt auseinandergehalten. Für das Verständnis der Thermodynamik ist dies jedoch wichtig. Aus diesem Grund, möchten wir die Begrifflichkeiten an einem illustrativen Beispiel verdeutlichen.
Betrachtet werden zwei hintereinanderfahrende Fahrzeuge. Vorne fährt ein relativ langsames Motorrad, gefolgt von einem schneller fahrenden Auto. Beiden Fahrzeugen lässt sich gemäß ihrer Geschwindigkeit und Masse eine bestimmte Bewegungsenergie zuordnen. Diese Bewegungsenergie steht im übertragenen Sinne für die Temperatur eines Stoffes.

Die Bewegungsenergie ist aber nur eine von vielen Energieformen, die das Fahrzeug besitzt. Im Tank des Fahrzeuges, genauer gesagt im Treibstoff, ist bspw. chemische Energie vorhanden. Ebenso in der Autobatterie. Haben die Fahrzeuge ihr Licht an, so haben diese offensichtlich auch elektromagnetische Energie. Alle diese Energieformen, die die Fahrzeuge jeweils haben, entsprechen im übertragenen Sinne der inneren Energie.
Die Bewegungsenergie ist also nur ein Teil der inneren Energie. Dass die Bewegungsenergie meist separat zur inneren Energie gezählt wird, hat lediglich den Grund, da nur die Bewegungsenergie direkt mit der Temperatur verknüpft ist (zu diesem Zusammenhang zwischen Bewegungsenergie und Temperatur siehe Artikel Druck und Temperatur). Während die innere Energie also den energetischen Gesamtzustand beschreibt, ergibt sich die Temperatur nur aufgrund der Bewegungsenergie.
Der Begriff Wärme kommt erst dann ins Spiel, wenn das schnellere Auto auf das langsamere Motorrad auffährt. In diesem Fall wird nämlich ein Teil der Bewegungsenergie vom Auto auf das Motorrad übertragen. Genau diese „Stoßenergie“, die aufgrund der unterschiedlichen Geschwindigkeiten („unterschiedliche Temperaturen“) beim Auffahren übertragen wird, entspricht im übertragenen Sinne der Wärme.

In diesem Fall wird der Energieübertrag genutzt, um das langsamere Motorrad schneller zu machen (Erhöhung der Bewegungsenergie), d.h. im übertragenen Sinne die Temperatur zu erhöhen. Gleichzeitig verliert das schnellere Auto genau diesen Energiebetrag und wird dadurch langsamer (Verringerung der Bewegungsenergie). Folglich verringert sich im übertragenen Sinne die Temperatur. Im selben Maße wie sich der energetische Gesamtzustand des schnelleren Autos verringert, erhöht sich aufgrund der Energieerhaltung folglich der energetische Gesamtzustand des Motorrads (Verformungsenergien seinen an dieser Stelle vernachlässigt).
Im weiteren Verlauf muss das Motorrad aber den Geschwindigkeitszuwachs nicht notwendigerweise beibehalten. Es könnte bspw. den Überschuss an Geschwindigkeit nutzen, um damit die Autobatterie weiter aufzuladen. Die dem Motorrad zugeführte „Stoßenergie“ wird im übertragenen Sinne also ganz allgemein in innere Energie umgewandelt. Man kann daraus schlussfolgern: Ein Gegenstand der Wärme abgibt*, verringert hierdurch seine innere Energie; und jener Gegenstand, der diese Wärmeenergie aufnimmt, erhöht im selben Maße seine innere Energie.
*) Der Begriff „Wärme abgeben“ lässt sich sprachlich fast nicht vermeiden, ist aber grundsätzlich irreführend. Dies suggeriert nämlich, dass ein Gegenstand Wärme als Inhalt hätte, den er abgeben kann. Wärme ist aber niemals Inhalt eines Gegenstandes und kann deshalb auch nicht abgegeben werden. Wärme bezieht sich nur auf jenen Energiebetrag, der von einem Gegenstand aus der inneren Energie bezogen wird und der inneren Energie des anderen Gegenstands zugutekommt!
Die aufgenommene Wärmeenergie eines Gegenstandes muss also nicht zwangsläufig der Bewegungsenergie der darin befindlichen Teilchen zugutekommen, sondern kann den unterschiedlichen Formen der inneren Energie zuteilwerden. Folglich muss eine Wärmezufuhr nicht notwendigerweise mit einer Temperaturerhöhung verbunden sein. Ein einfaches Beispiel an dem dies deutlich wird, zeigt sich bspw. beim Verdampfen von Wasser auf einer Herdplatte. Trotz der permanent zugeführten Wärmeenergie der Herdplatte, ändert sich beim Verdampfen die Temperatur des Wassers nicht. In diesem Fall macht sich die zugeführte Wärmeenergie offensichtlich nicht in einer Temperaturerhöhung bemerkbar. Vielmehr wird die Wärmeenergie beim Verdampfen dazu genutzt die Bindungsenergien (die Teil der inneren Energie sind) zu ändern, sodass der Stoff von der flüssigen in die gasförmige Phase übergeht.
Temperaturangleichung von Festkörpern
Der Prozess der Energieübertragung durch Wärme findet nicht nur bei Stoffen statt deren Teilchen durch ihre freie Beweglichkeit Stoßprozesse ausüben können wie dies in Gasen oder Flüssigkeiten der Fall ist. Auch ohne Durchmischung der Teilchen kann Energie zwischen den Stoffen in Form von Wärme übertragen werden. Dies zeigt bereits ein einfacher Versuch bei dem zwei Festkörper mit zunächst unterschiedlichen Anfangstemperaturen in Kontakt miteinander gebracht werden. Obwohl sich die Teilchen der beiden Festkörper offensichtlich nicht durchmischen können, wird auch dort mit der Zeit ein Angleichen der Temperatur zu beobachten sein.
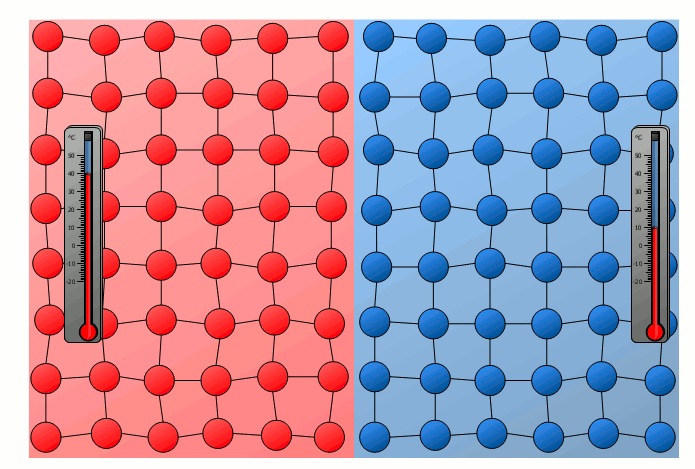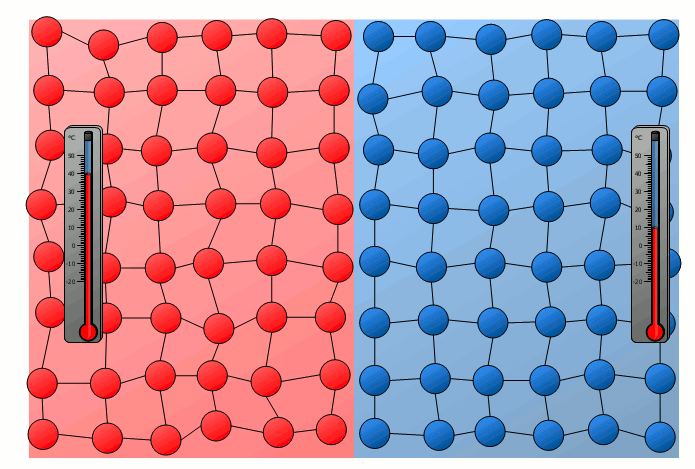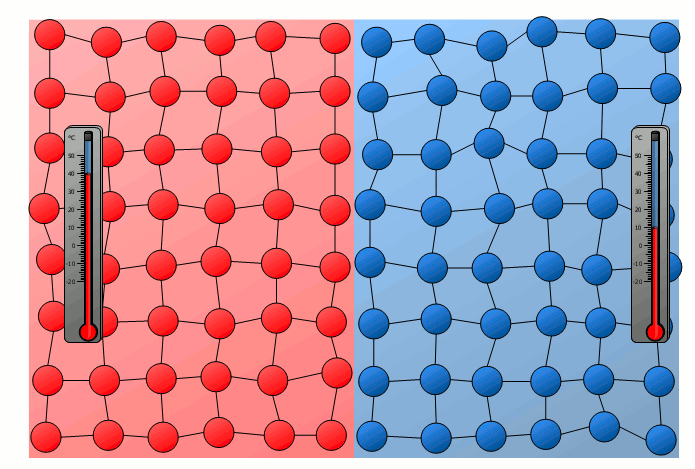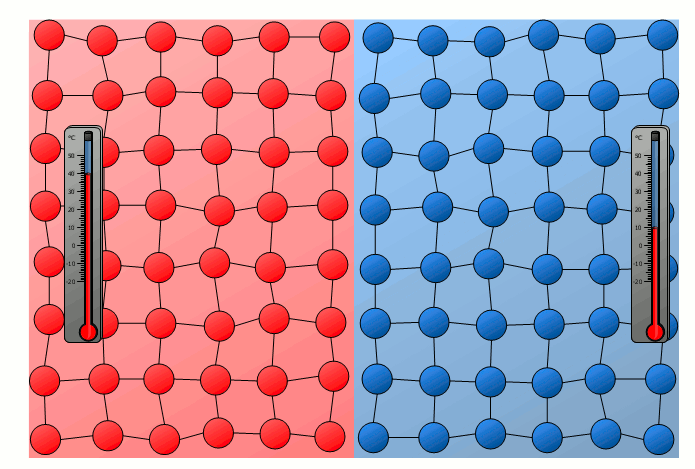
In diesem Fall lässt sich die Energieübertragung auf die schwingenden Teilchen an der Grenzfläche der beiden Körper zurückführen. So stoßen die stärker schwingenden Teilchen des heißeren Gegenstandes an der Kontaktfläche mit jenen schwächer schwingenden Teilchen des kühleren Körpers zusammen. Hierdurch werden die relativ langsam schwingenden Teilchen des kühlen Gegenstandes zu verstärkten Schwingungen angeregt bzw. die starken Schwingungen des heißeren Körpers „gedämpft“. Somit kommt es ebenfalls allmählich zu einer Anpassung der unterschiedlichen Schwingungsstärken und damit zu einem Angleichen der Temperatur.
Eine Energieübertragung in Form von Wärme kann aber auch ohne direkten Kontakt zweier Körper zustande kommen! Dies ist der Tatsache geschuldet, dass jeder Körper in Abhängigkeit seiner Temperatur elektromagnetische Strahlung aussendet (siehe Artikel Schwarzkörperstrahlung). Diese Temperaturstrahlung wird bspw. in Wärmebildkameras sichtbar gemacht. Die elektromagnetische Wärmestrahlung kann dabei ohne direkten Kontakt zu einem anderen Gegenstand dessen Teilchen zum Schwingen anregen.
Nähere Informationen auf welche Weise Wärme übertragen werden kann finden sich im Artikel Wärmeübertragung.