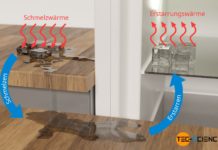
Verbrennungen an Wasserdampf sind deshalb gefährlicher, weil beim Kondensieren zusätzlich latente Wärme in Form von Kondensationswärme freigesetzt wird.
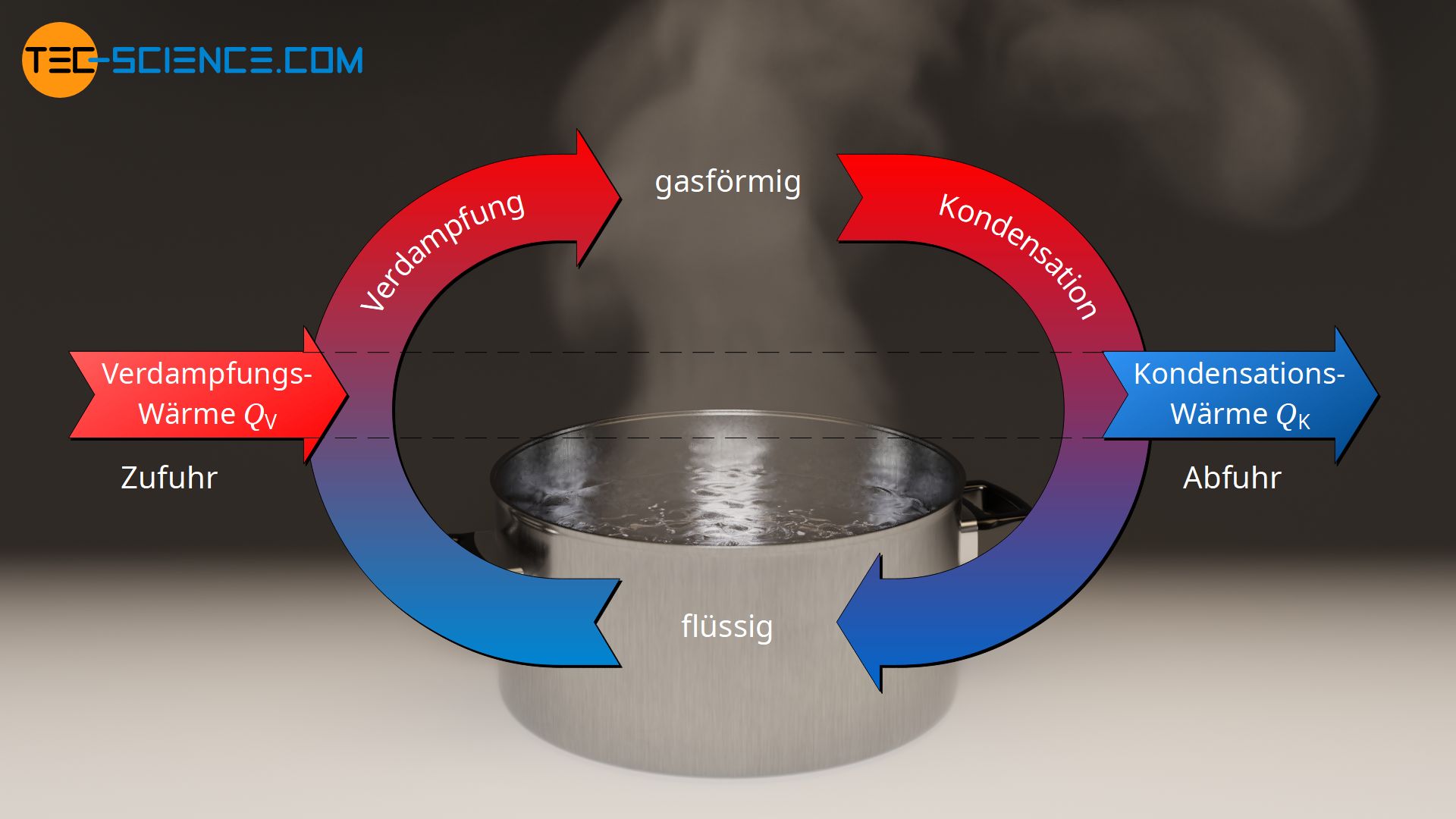
Um einen flüssigen Stoff zu verdampfen muss Wärme zugeführt werden, um die intermolekularen Bindungen aufzubrechen, damit die Moleküle in die Gasphase übergehen können. Bei Reinstoffen bleibt die Temperatur dabei solange konstant, bis die Flüssigkeit vollständig verdampft ist. Die zugeführte Wärme während der Verdampfung mach sich also deshalb nicht in einer Temperaturerhöhung bemerkbar, da die zugeführte Energie für das Aufbrechen der intermolekularen Bindungen genutzt wird (Aufbrechen der Wasserstoffbrückenbindung). Die zur vollständigen Verdampfung einer bestimmten Menge an Flüssigkeit zuzuführende Wärme wird auch als Verdampfungswärme bzw. ganz allgemein als latente Wärme bezeichnet.
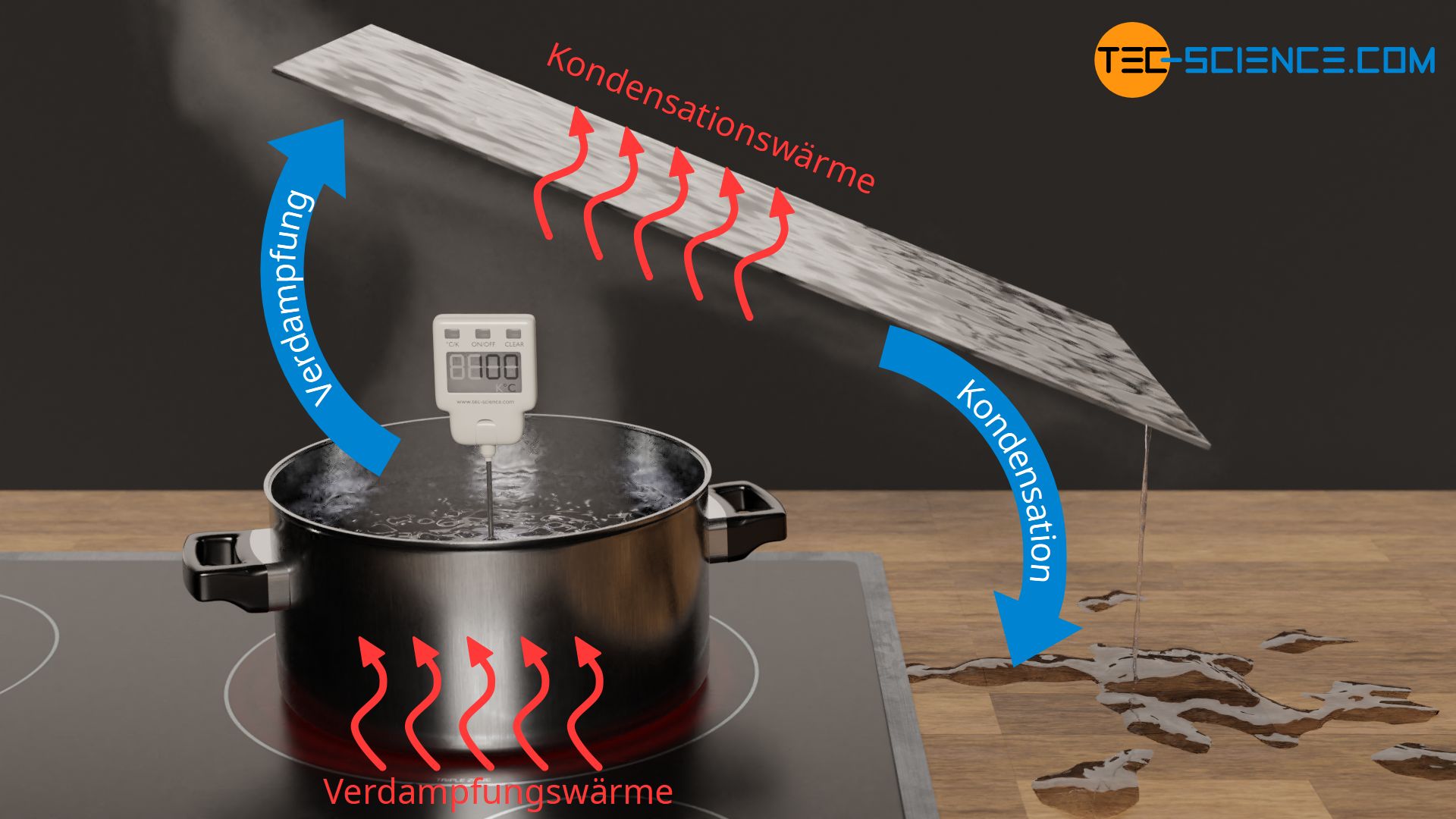
Wasser benötigt eine sehr große Wärmemenge zur Verdampfung. So ist für das Verdampfen von 1 kg Wasser eine Wärmeenergie von 2257 kJ notwendig. Vergleicht man diese Wärmeenge mit der Erwärmung des Wassers von 20 °C auf 100 °C, so sind hierfür nur 336 kJ notwendig. Es muss also mehr als 6 mal so viel Wärme für die Verdampfung aufgewendet werden wie für die Erwärmung notwendig war! Die zugeführte Verdampfungswärme kann auf Grund der Energieerhaltung nicht einfach verschwunden sein. Vielmehr steckt diese enorme Energiemenge im nun gasförmigen Wasser (sie ist als innere Energie in der Gasphase gespeichert).
Wasser benötigt zum Verdampfen ein Vielfaches der Wärmemenge im Vergleich zur Erwärmung auf Siedetemperatur!
Beim Kondensieren, d.h. wenn sich das gasförmige Wasser an einem kalten Gegenstand verflüssigt, wird die zuvor aufgenommene Verdampfungsenergie wieder frei. Die freigewordene Wärme wird vom kühleren Gegenstand aufgenommen. Die (innere) Energie des Wassers sinkt und die intermolekularen Bindungen können sich wieder ausbilden und sorgen für den typischen flüssigen Zustand des Wassers. Man spricht im Falle des Kondensierens auch von der Kondensationswärme, die ebenfalls eine Form der latenten Wärme darstellt. Die Kondensationswärme ist gleich groß wie die Verdampfungswärme.
Die beim Verdampfen aufgenommene Energie in Form von Verdampfungswärme (latente Wärme) wird beim Kondensieren in Form von Kondensationswärme (latente Wärme) wieder frei!
Mit diesem Verständnis lässt sich nun auch erklären, weshalb Verbrennungen an gasförmigem Wasserdampf im Allgemeinen deutlich schmerzhafter und gefährlicher sind als Verbrennungen an flüssigem Wasser. Kommt unsere relativ kühle Haut nämlich mit dem gasförmigen Wasserdampf in Berührung, dann kondensiert dort das Wasser und die freiwerdende Kondensationsenergie wird auf unsere Haut übertragen. Wie bereits erläutert, handelt es sich aufgrund der großen latenten Wärme dabei um eine riesige Wärmeenergie, die übertragen wird. In Kontakt mit Wasserdampf wird beim Kondensieren folglich deutlich mehr Wärmeenergie auf unsere Haut übergehen als beim Kontakt mit flüssigem Wasser, obwohl in beiden Fällen die Temperatur des gasförmigen bzw. flüssigen Wassers 100 °C beträgt.
Verbrennungen an Wasserdampf sind im Vergleich zu flüssigem Wasser deshalb gefährlicher, weil beim Kondensieren zusätzlich latente Wärme in Form von Kondensationswärme übertragen wird.
Beachte, dass das Empfinden für warm oder kalt nicht auf Temperaturen beruht, sondern auf Wärmeströme zurückzuführen ist (als Wärmestrom bezeichnet man die pro Zeit übertragene Wärme). Obwohl also die Temperaturen mit 100 °C in beiden Fällen identisch sind, kommt beim Kondensieren ein deutlich größerer Wärmestrom zustande. Dieser größere Wärmestrom ruft nicht nur ein psychisch wärmeres Empfinden hervorruft, sondern führt auch physisch zu gefährlicheren Verbrennungen. Mehr Informationen zum Wärmeempfinden finden sich im Artikel Warum fühlt sich Metall kälter an als Holz (menschliches Wärmeempfinden).