Aufgrund der Kompressibilität muss bei Gasen zwischen der isobaren und der isochoren spezifischen Wärmekapazität unterschieden werden.
Unterscheidung zwischen isochorer und isobarer Wärmezufuhr
Anders als bei flüssigen oder festen Materialien, kommt bei gasförmigen Stoffen eine Besonderheit bezüglich der spezifischen Wärmekapazität hinzu. Für diese Stoffe muss beachtet werden, auf welche Weise die Wärme zugeführt wird. Dabei müssen zwei Fälle unterschieden werden, die anhand eines Experimentes im Folgenden verdeutlicht werden sollen:
- Wärmezufuhr bei konstantem Volumen (isochorer Prozess)
- Wärmezufuhr bei konstantem Druck (isobarer Prozess)
Versuchsaufbau
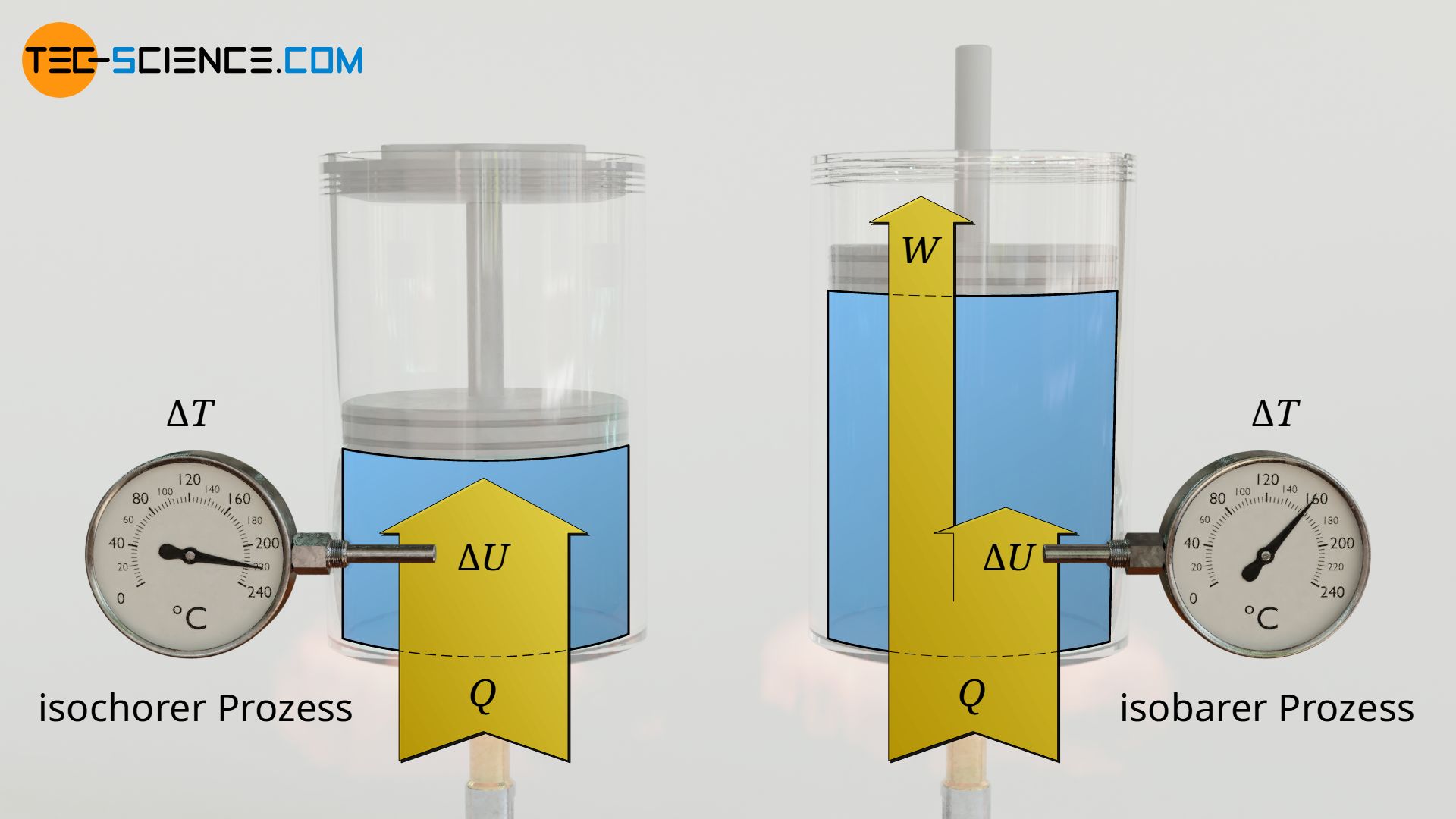
Im ersten Fall wird während der Erwärmung das eingeschlossene Gasvolumen konstant gehalten. Dies geschieht durch Arretierung des Kolbens im Zylinder. Hierdurch wird der Gasdruck im Zylinder während der Erwärmung ansteigen (wie dies bspw. bei Schnellkochtöpfen der Fall ist). Ein solcher thermodynamischer Vorgang bei dem das Volumen konstant bleibt, wird isochorer Prozess genannt.

Ein Prozess, bei dem sich das Volumen eines eingeschlossenen Gases nicht ändert, wird isochorer Prozess genannt!
Im zweiten Fall wird während der Erwärmung der Gasdruck konstant gehalten. Dies wird dadurch erreicht, dass sich der Kolben diesmal frei im Zylinder bewegen. Hierdurch kann das Gas dem ansteigenden Druck durch eine Volumenvergrößerung „nachgeben“ (wie dies bspw. in Dieselmotoren während der Verbrennung der Treibstoffgase näherungsweise der Fall ist). Ein thermodynamischer Vorgang bei dem der Druck konstant bleibt, wird isobarer Prozess genannt!
Ein Prozess, bei dem sich der Druck eines eingeschlossenen Gases nicht ändert, wird isobarer Prozess genannt!
Versuchsdurchführung
Weshalb diese beiden Prozesse bei Gasen unterschieden werden müssen, zeigt sich, wenn man dem Gas nun Wärme zuführt und dabei den Temperaturanstieg jeweils beobachtet. Hierzu wird in beiden Fällen das Gas mit Hilfe eines Bunsenbrenners für eine gleich lange Zeit erwärmt. Somit kann davon ausgegangen werden, dass in beiden Fällen dieselbe Wärmemenge zugeführt wurde.
Dabei zeigt sich allerdings, dass beim isochoren Prozess der Temperaturanstieg deutlich größer ausfällt als beim isobaren Prozess. Ein weiterer Unterschied in der Beobachtung der Experimente besteht darin, dass sich beim isobaren Prozess das Gasvolumen durch die Erwärmung ausdehnt und damit den Kolben nach oben drückt.
Versuchsauswertung
Worin liegt die unterschiedlich große Temperaturänderung in beiden Fällen nun begründet?
Während beim isobaren Prozess offensichtlich Arbeit vom Gas verrichtet wurde, um den Kolben entgegen dessen Gewichtskraft (und entgegen dem Umgebungsdruck!) nach oben zu drücken, wurde bei der isochoren Erwärmung keine Arbeit umgesetzt. Die zugeführte Wärmeenergie wird beim isobaren Prozess also nicht vollständig genutzt, um den Gasteilchen mehr Bewegungsenergie zu verleihen und damit die Gastemperatur zu erhöhen. Ein Teil der zugeführten Wärmeenergie wird in Arbeit umgewandelt und steht somit nicht für die Temperaturerhöhung zur Verfügung. Derjenige Anteil der Wärmeenergie, der zur Erhöhung der Bewegungsenergie der Teilchen und damit zur Temperaturerhöhung führt, kommt sozusagen dem „Inneren“ des Gases zugute und wird deshalb auch als innere Energie ΔU bezeichnet.
Die Temperaturerhöhung fällt im isobaren Fall also geringer aus, obwohl dieselbe Wärmemenge zugeführt wurde. Der Zusammenhang zwischen der zugeführten Wärme und der Temperaturänderung sind für den isochoren Prozess und den isobaren Prozess folglich unterschiedlich. Dies führt dazu, dass die spezifischen Wärmekapazitäten für Gase je nach Prozess der Wärmezufuhr unterschiedlich sind (Wärme wird neben der Arbeit deshalb auch als Prozessgröße bezeichnet).
Anmerkung: Da sich das Gasvolumen beim isobaren Prozess während der Verrichtung der Arbeit offensichtlich ausdehnen muss, spricht man in diesem Zusammenhang auch von Volumenänderungsarbeit oder Volumenarbeit (Ausdehnungsarbeit) die das Gas zu verrichten hat. Beachte, dass das Gas auch selbst dann Arbeit verrichten müsste, wenn der Kolben keine Gewichtskraft hätte. In diesem Fall müsste sich das Gas zwar lediglich entgegen des umgebenden Luftdruckes (1 bar) ausdehnen, aber selbst dies erfordert Arbeit.
Schlussfolgerung
Wie sich gezeigt hat, führt bei einer isobaren Erwärmung dieselbe zugeführte Wärmemenge also zu einer geringeren Temperaturänderung als bei einer isochoren Erwärmung. Umgekehrt bedeutet dies: Um dieselbe Temperaturänderung zu erhalten muss bei einer isobaren Erwärmung offensichtlich mehr Wärme bereit gestellt werden, um damit die verrichtete Arbeit zu kompensieren. Die spezifische Wärmekapazität ist im isobaren Fall folglich stets größer im Vergleich zum isochoren Prozess!
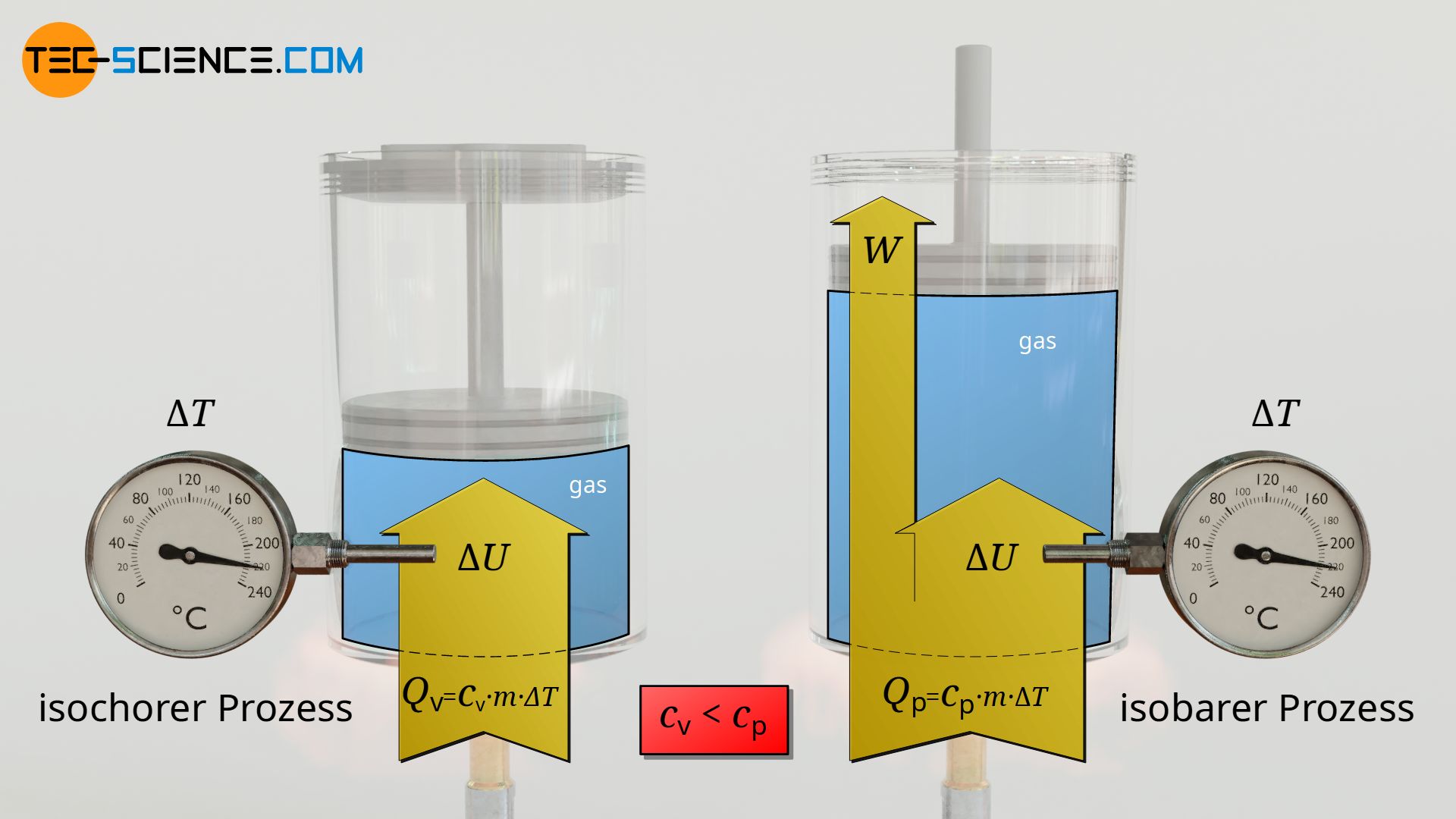
Die spezifische Wärmekapazität des isobaren Prozesses ist stets größer im Vergleich zur spezifischen Wärmekapazität des isochoren Prozesses, da zusätzlich Arbeit verrichtet werden muss!
Zur Unterscheidung wird die spezifische Wärmekapazität für Wärmeumsätze bei konstantem Druck deshalb mit cp bezeichnet und für Vorgänge bei konstantem Volumen mit cv. Für Luft bspw. beträgt cp=1,005 kJ/(kg⋅K) und cv=0,718 kJ/(kg⋅K).
\begin{align}
& \boxed{Q_\text{v} = c_\text{v} \cdot m \cdot \Delta T} ~ \text{isochor zugeführte Wärme} \\[5px]
& \boxed{Q_\text{p} = c_\text{p} \cdot m \cdot \Delta T} ~ \text{isobar zugeführte Wärme} \\[5px]
& \boxed{c_\text{p} > c_\text{v}} \\[5px]
\end{align}
Genauere Untersuchungen zeigen, dass die spezifische Wärmekapazität des isobaren Prozesses cp um den Wert der spezifischen Gaskonstante Rs größer ist als die spezifische Wärmekapazität des isochoren Prozesses cv.
\begin{align}
&\boxed{c_\text{p} = c_\text{v} + R_\text{s}}
\end{align}
Unterscheidung für inkompressible Stoffe wie Flüssigkeiten und Festkörper
Beachte, dass die Unterscheidung zwischen cp und cv nur für Stoffe relevant ist, die prinzipiell in der Lage sind Volumenarbeit zu verrichten, d.h. sich entgegen eines Druckes ausdehnen können. Dies trifft in der Praxis letztlich nur für kompressible Stoffe wie Gase zu. Für Festkörper und Flüssigkeiten ist eine solche Unterscheidung hinfällig, da diese im Gegensatz zu Gasen inkompressibel sind. Solche Stoffe können unter Druck ihr Volumen praktisch nicht ändern und folglich auch keine Volumenarbeit verrichten. Die geringe Wärmeausdehnung ist dabei zu vernachlässigen. Deshalb wird für Festkörper und Flüssigkeiten lediglich das Symbol c (ohne Index) als spezifische Wärmekapazität verwendet.